Діоксид вуглецю (вуглекислий газ) – часто зустрічається в природі з’єднання. Воно утворюється при окисленні різних органічних речовин. Найбільш часто зустрічаються процеси утворення цієї сполуки – гниття тварин та рослинних решток, горіння різних видів палива, дихання тварин і рослин. Наприклад, одна людина за добу виділяє в атмосферу близько кілограма вуглекислого газу. Оксид і діоксид вуглецю можуть утворюватися і в неживій природі. Вуглекислий газ виділяється при вулканічній діяльності, а також може бути видобуто з мінеральних водних джерел. Вуглекислий газ знаходиться у невеликим кількості і в атмосфері Землі.
Особливості хімічної будови даного з’єднання дозволяють йому брати участь у безлічі хімічних реакцій, основою для яких є діоксид вуглецю.
Формула
У з’єднанні цієї речовини чотирьохвалентний атом вуглецю утворює лінійну зв’язок з двома молекулами кисню. Зовнішній вигляд такої молекули можна представити так: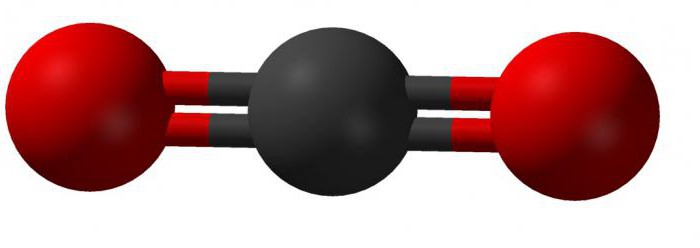
Теорія гібридизації пояснює будову молекули діоксиду вуглецю так: дві існуючі сигма-зв’язку утворені між sp-орбіталей атомів вуглецю і двома 2р-орбіталей кисню; р-орбіталі вуглецю, які не беруть участь в гібридизації, пов’язані в з’єднанні з аналогічними орбіталей кисню. У хімічних реакціях вуглекислий газ записується у вигляді: CO2.
Фізичні властивості
При нормальних умовах діоксид вуглецю являє собою безбарвний газ, який не володіє запахом. Він важчий за повітря, тому вуглекислий газ і може вести себе, як рідина. Наприклад, його можна переливати з однієї ємності в іншу. Це речовина трохи розчиняється в воді – в одному літрі води при 20 ?С розчиняється близько 0,88 л CO2. Невелике зниження температури кардинально змінює ситуацію – в тому ж літрі води при 17?С може розчинитися 1,7 л CO2. При сильному охолодженні це речовина осідає у вигляді сніжинок – утворюється так званий «сухий лід». Така назва походить від того, що при нормальному тиску речовина, минаючи рідку фазу, відразу перетворюється в газ. Рідкий діоксид вуглецю утворюється при тиску трохи вище 0,6 МПа і при кімнатній температурі.
Хімічні властивості
При взаємодії з сильними окислювачами 4-діоксид вуглецю виявляє окисні властивості. Типова реакція цієї взаємодії:
З + З2 = 2СО.
Так, за допомогою вугілля діоксид вуглецю відновлюється до своєї двовалентній модифікації – чадного газу.
При нормальних умовах вуглекислий газ інертний. Але деякі активні метали можуть в ньому горіти, витягуючи з з’єднання кисень і вивільняючи газоподібний вуглець. Типова реакція – горіння магнію:
2Mg + CO2 = 2MgO + C.
В процесі реакції утворюється оксид магнію і вільний вуглець.
У хімічних сполуках З2 часто проявляє властивості типового кислотного оксиду. Наприклад, він реагує з підставами та основними оксидами. Результатом реакції стають солі вугільної кислоти.
Наприклад, реакція сполуки оксиду натрію з вуглекислим газом може бути представлена так:
Na2O + CO2 = Na2CO3;
2NaOH + CO2 = Na2CO3 + H2O;
NaOH + CO2 = NaHCO3.
Вугільна кислота та розчин З2
Діоксид вуглецю у воді утворює розчин з невеликим ступенем дисоціації. Такий розчин вуглекислого газу називається вугільної кислотою. Вона безбарвна, слабо виражена і має кислуватий смак.
Запис хімічної реакції:
CO2 + H2O ? H2CO3.
Рівновага досить сильно зрушено вліво – лише близько 1% початкової вуглекислого газу перетворюється у вугільну кислоту. Чим вище температура, тим менше в розчині молекул вугільної кислоти. При кипінні з’єднання вона зникає повністю, і розчин розпадається на діоксид вуглецю і воду. Структурна формула вугільної кислоти представлена нижче.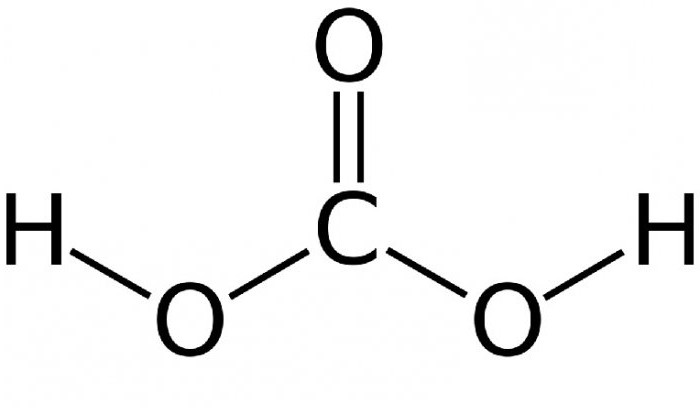
Властивості вугільної кислоти
Вугільна кислота дуже слабка. У розчинах вона розпадається на іони водню Н+ і з’єднання НСО3– . У дуже невеликій кількості утворюються іони З3–.
Вугільна кислота – двухосновная, тому солі, утворені нею, можуть бути середніми і кислими. Середні солі в російській хімічної традиції називаються карбонатами, а сильні – гидрокарбонатами.
Якісна реакція
Одним з можливих способів виявлення газоподібного діоксиду вуглецю є зміна прозорості вапняного розчину.
Ca(OH)2 + CO2 = CaCO3? + H2O.
Цей досвід відомий ще з шкільного курсу хімії. На початку реакції утворюється невелика кількість білого осаду, який згодом зникає при пропущенні через воду вуглекислого газу. Зміна прозорості відбувається тому, що в процесі взаємодії нерозчинну сполуку – карбонат кальцію перетворюється на розчинну речовину – гідрокарбонат кальцію. Реакція протікає по такому шляху:
CaCO3 + H2O + CO2 = Ca(HCO3)2.
Отримання діоксиду вуглецю
Якщо потрібно отримати невелику кількість СО2, можна запустити реакцію соляної кислоти з карбонатом кальцію (мармуром). Хімічна запис цієї взаємодії виглядає так:
CaCO3 + HCl = CaCl2 + H2O + CO2 ?.
Також для цієї мети використовують реакції горіння вуглецевмісних речовин, наприклад ацетилену:
СН4 + 2О2 ? 2H2O + CO2.
Для збору і зберігання отриманого газоподібного речовини використовують апарат Киппа.
Для потреб промисловості і сільського господарства масштаби отримання діоксиду вуглецю повинні бути великими. Популярним методом такої масштабної реакції є випал вапняку, в результаті якого виходить діоксид вуглецю. Формула реакції наведена нижче:
CaCO3 = CaO + CO2 ?.
Застосування діоксиду вуглецю
Харчова промисловість після масштабного одержання «сухого льоду» перейшла на принципово новий метод зберігання продуктів. Він незамінний при виробництві газованих напоїв і мінеральної води. Вміст СО2 в напоях надає їм свіжість і помітно збільшує термін зберігання. А карбідізация мінеральних вод дозволяє уникнути затхлості і неприємного смаку.
У кулінарії часто використовують метод погашення лимонної кислоти оцтом. Виділяється при цьому вуглекислий газ надає пишність і легкість кондитерським виробам.
Дане з’єднання часто використовується в якості харчової добавки, що підвищує термін зберігання харчових продуктах. Згідно міжнародним нормам класифікації хімічних добавок вмісту в продуктах, проходить під кодом Е 290,
Порошкоподібний вуглекислий газ – одна з найбільш популярних речовин, що входять до складу пожаротушительных сумішей. Ця речовина зустрічається і в піні вогнегасників.
Транспортувати та зберігати вуглекислий газ у металевих балонах. При температурі більше 31?С тиск у балоні може досягти критичного і рідкий З2 перейде в надкритичний стан з різким підйомом робочого тиску до 7,35 МПа. Металевий балон витримує внутрішній тиск до 22 МПа, тому діапазон тиску при температурах понад тридцяти градусів визнається безпечним.






