Хімія – дивовижна і, зізнатися, заплутана наука. Чомусь вона асоціюється з яскравими експериментами, різнокольоровими пробірками, густими хмарами пари. Але мало хто замислюється про те, звідки ж береться це «чари». Насправді жодна реакція не проходить без утворення сполук між атомами реагентів. Більше того, ці «перемички» іноді зустрічаються і в простих елементах. Вони впливають на здатність речовин вступати в реакції і пояснюють деякі їх фізичні властивості.
Які ж бувають види хімічних зв’язків і як вони впливають на з’єднання?
Теорія
Починати треба з найпростішого. Хімічний зв’язок – це взаємодія, при якому атоми речовин з’єднуються і утворюють більш складні речовини. Помилково вважати, що це властиво тільки з’єднанням начебто солей, кислот і підстав – навіть прості речовини, молекули яких складаються з двох атомів, що мають ці «перемички», якщо так можна умовно назвати зв’язок. До речі, важливо запам’ятати, що можуть об’єднатися тільки атоми, які мають різні заряди (це основи фізики: однаково заряджені частинки відштовхуються, а протилежні – притягаються), так що в складних речовинах завжди знайдеться катіон (іон з позитивним зарядом) і аніон (негативна частка), а саме з’єднання завжди буде нейтральним.

Тепер спробуємо розібратися в тому, як відбувається утворення хімічного зв’язку.
Механізм утворення
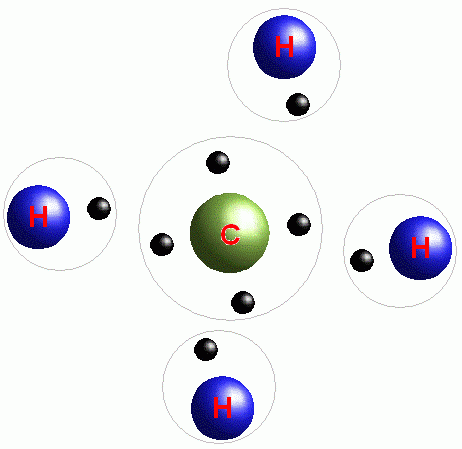
У будь-якої речовини є певна кількість електронів, розподілених по енергетичних шарів. Самим уразливим вважається зовнішній шар, на якому зазвичай знаходиться найменша кількість цих частинок. Дізнатися їх число можна, подивившись на номер групи (рядок з цифрами від одного до восьми у верхній частині таблиці Менделєєва), в якій знаходиться хімічний елемент, а кількість енергетичних шарів одно номером періоду (від одного до семи, вертикальна рядок ліворуч від елементів).
В ідеалі на зовнішньому енергетичному шарі знаходяться вісім електронів. Якщо ж їх не вистачає, атом намагається перетягнути їх в іншої частинки. Саме в процесі відбору необхідних для завершення зовнішнього енергетичного шару електронів утворюються хімічні зв’язки речовин. Їх число може змінюватись і залежить від кількості валентних, або неспарених, часток (щоб дізнатися, скільки їх в атомі, потрібно скласти електронну формулу). Число електронів, що не мають пару, буде дорівнює кількості утворилися зв’язків.
Трохи докладніше про типи
Види хімічних зв’язків, що утворюються при реакціях або ж просто в молекулі якоїсь речовини, цілком і повністю залежать від самого елементу. Розрізняють три типу «перемичок» між атомами: іонний, металевий і ковалентный. Останній, у свою чергу, ділиться на полярний і неполярний.
Для того щоб зрозуміти, який зв’язком зв’язані атоми, використовують своєрідне правило: якщо елементи розташовані в правій і лівій частинах таблиці (тобто є металом і неметаллом, наприклад NaCl), то їх з’єднання – відмінний приклад іонного зв’язку. Два неметали утворюють ковалентную полярну зв’язок (HCl), а два атоми одного речовини, з’єднуючись в одну молекулу, – ковалентную неполярних (Cl2, O2). Вищеназвані типи хімічних зв’язків не підходять для речовин, що складаються з металів, – там зустрічається виключно металева зв’язок.
Ковалентное взаємодія
Як вже згадувалося раніше, види хімічних зв’язків мають певний вплив на речовини. Так, наприклад, ковалентний «перемичка» дуже нестійка, з-за чого з’єднання з нею легко руйнуються при найменшому зовнішньому впливі, нагріванні наприклад. Правда, це стосується тільки молекулярних речовин. Ті ж, що мають немолекулярное будова, практично незруйновними (ідеальний приклад – кристал алмазу – з’єднання атомів вуглецю).

Повернемося до полярного й неполярного ковалентного зв’язку. З неполярною все просто – електрони, між якими утворюється «перемичка», знаходяться на рівній відстані від атомів. Але в другому випадку вони зміщуються до одного з елементів. Переможцем у «перетягуванні» виявиться речовина, электроотрицательность (здатність притягувати електрони) якого вище. Визначається вона за спеціальними таблицями, і чим більше різниця цієї величини у двох елементів, тим більш полярної буде зв’язок між ними. Правда єдине, для чого може знадобитися знання електронегативності елементів, – визначення катіона (позитивний заряд – речовина, у якого ця величина буде менше) і аніону (негативна частка з кращою здатністю до залучення електронів).
Іонна зв’язок
Для з’єднання металів і неметалів підходять далеко не всі типи хімічних зв’язків. Як вже говорилося вище, якщо різниця електронегативності елементів величезна (а саме так буває, коли вони розташовані в протилежних частинах таблиці), між ними утвориться іонний зв’язок. У цьому випадку валентні електрони переходять від атома з меншою электроотрицательностью до атома з більшою, утворюючи аніон і катіон. Найяскравішим прикладом такого зв’язку є з’єднання галогену і металу, наприклад AlCl2 або HF.
Металева зв’язок
З металами все ще простіше. Їм чужі перераховані вище види хімічних зв’язків, тому що у них є власна. З’єднувати вона може як атоми одного речовини (Li2), так і різних (AlCr2), в останньому випадку утворюються сплави. Якщо говорити про фізичні властивості, то метали поєднують в собі пластичність і міцність, тобто вони не руйнуються при найменшому впливі, а просто змінюють форму.

Межмолекулярная зв’язок
До речі, хімічні зв’язки в молекулах теж існують. Вони так і називаються – міжмолекулярними. Найпоширеніший тип – воднева зв’язок, при якому атом водню запозичує електрони у елемента з високою электроотрицательностью (молекули води, наприклад).