Вкрай цінними для всього людства властивостями володіє такою газ, як озон. Хімічний елемент, яким він утворений, – це кисень О. насправді, озон Про3 – одна з аллотропних модифікацій оксигена, що складається з трьох формульних одиниць (Про?Про?Про). Перше і більш відоме з’єднання – це сам кисень, точніше газ, який утворений двома атомами (О=О) – О2.
Алотропія – це здатність одного хімічного елемента утворювати ряд різних за властивостями простих сполук. Завдяки їй людство вивчив і використовує такі речовини, як алмаз і графіт, моноклинная і ромбічна сірка, кисень і озон. Хімічний елемент, що має таку здатність, не обов’язково обмежений лише двома модифікаціями, у деяких їх більше.
Історія відкриття з’єднання
Складова одиниця багатьох органічних і мінеральних речовин, в тому числі і такого як озон – хімічний елемент, позначення якого Про – оксиген, в перекладі з грецького «oxys» – кислий, і «gignomai» – народжувати.
Вперше нову алотропні модифікації кисню під час дослідів з електричними розрядами виявив у 1785 році голландець Мартін ван Маруна, його увагу привернув специфічний запах. А століттям пізніше француз Шенбейн відзначив присутність такого ж після грози, в результаті чого газ був названий «пахне». Але вчені дещо помилилися, вважаючи, що їх нюх відчуло сам озон. Запах, який вони відчували, належав органічних сполук, окисленим при взаємодії з3, так як газ дуже реакційноздатний.
Електронна будова
Один і той же структурний фрагмент мають О2 і О3 – хімічний елемент. Озон має більш складну будову. У кисні ж все просто – два атома оксигена з’єднані подвійним зв’язком, що складається з ? – і ?-складової, відповідно валентності елемента. Про3 має кілька резонансних структур. 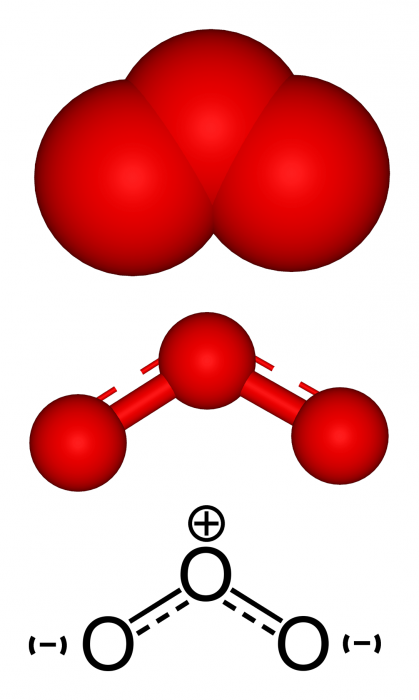 Кратна зв’язок з’єднує два кисню, а третій має одинарну. Таким чином, внаслідок міграції ?-складової, в загальній картині три атоми мають полуторна з’єднання. Ця зв’язок коротше, ніж одинарна, але довше, ніж подвійна. Ймовірність циклічності молекули проведені вченими експерименти виключають.
Кратна зв’язок з’єднує два кисню, а третій має одинарну. Таким чином, внаслідок міграції ?-складової, в загальній картині три атоми мають полуторна з’єднання. Ця зв’язок коротше, ніж одинарна, але довше, ніж подвійна. Ймовірність циклічності молекули проведені вченими експерименти виключають.
Методи синтезу
Для утворення такого газу, як озон, хімічний елемент оксиген повинен знаходитися в газоподібному середовищі у вигляді окремих атомів. Такі умови створюються при зіткненні молекул кисню Про2 з електронами під час електричних розрядів або іншими частками з великою енергією, а також при його опроміненні ультрафіолетом.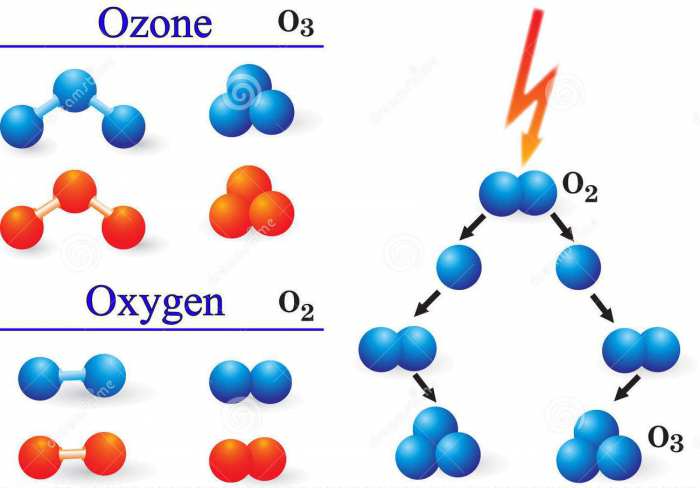
Левова частка від загальної кількості озону в природних умовах атмосфери утворюється фотохімічним способом. Людина віддає перевагу в хімічній діяльності використовувати інші методи, такі як, наприклад, електролітичний синтез. Він полягає в тому, що у водне середовище електроліту поміщають платинові електроди і пускають струм. Схема реакції:
Н2О + О2 ? Про3 + Н2 + е–
Фізичні властивості
Кисень (О) – складова одиниця такої речовини як озон – хімічний елемент, формула якого, а також відносна молярна маса вказані в таблиці Менделєєва. Утворюючи Про3, оксиген набуває властивостей, що кардинально відрізняються від властивостей О2.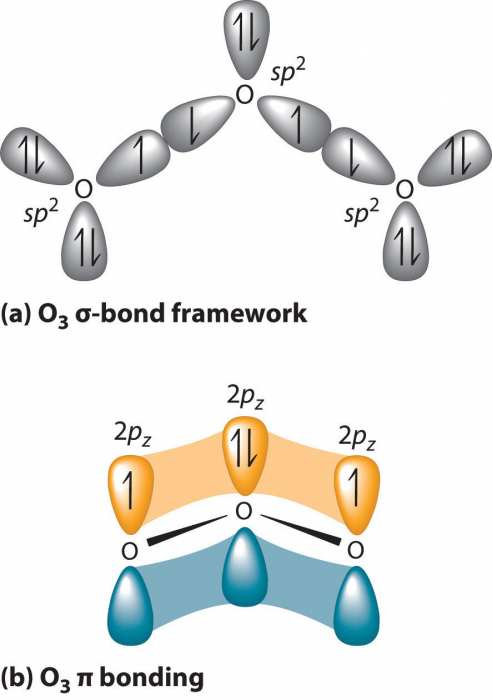
Газ блакитного кольору – це звичайний стан такого з’єднання, як озон. Хімічний елемент, формула, кількісні характеристики – все це визначили при ідентифікації і вивченні даної речовини. Температура кипіння для нього -111,9 °C, зріджене стан має темно-фіолетовий колір, при подальшому зниженні градуси до -197,2 °C починається плавлення. У твердому агрегатному стані озон набуває чорний колір з фіолетовим відливом. Розчинність його в десять разів перевищує це властивість кисню О2. При незначних концентраціях у повітрі відчувається запах озону, він різкий, специфічний і нагадує запах металу.
Хімічні властивості
Дуже активним, з реакційної точки зору, є газ озон. Хімічний елемент, який його утворює – це кисень. Характеристики, що визначають поведінку озону у взаємодії з іншими речовинами, – це висока oxidizing здатність і нестійкість самого газу. При підвищених температурах він розкладається з небувалою швидкістю, прискорюють процес і каталізатори, такі як оксиди металів, хлор, діоксид азоту та інші. Властивості окислювача притаманні озону завдяки особливостям будови молекули й рухливості одного з атомів оксигена, який отщепляясь, перетворює газ в кисень: Про3 ? Про2 + О·
Оксиген (цеглинка, з якого побудовані молекули таких речовин, як кисень і озон) – хімічний елемент. Як пишеться в рівняннях реакції – Про·. Озон окисляє всі метали, за винятком золота, платини та її підгрупи. Він реагує з газами, що знаходяться в атмосфері – оксидами сірки, азоту та іншими. Не залишаються інертними і органічні речовини, особливо швидко йдуть процеси розриву кратних зв’язків через утворення проміжних сполук. Вкрай важливо, що продукти реакцій є нешкідливими для навколишнього середовища і людини. Це вода, кисень, вищі оксиди різних елементів, окисли вуглецю. У взаємодію з озоном не вступають бінарні сполуки кальцію, титану і кремнію з киснем.
Застосування
Основна сфера, де застосовується «пахне» газ – це озонування. Подібний метод стерилізації набагато ефективніше і безпечніше для живих організмів, ніж дезінфекція хлором. При очищенні води озоном не відбувається утворення токсичних похідних метану, заміщених небезпечним галогеном.
Все частіше такий екологічний метод стерилізації знаходить застосування в харчовій галузі промисловості. Озоном обробляють холодильне обладнання, складські приміщення для продуктів, з допомогу нього проводять усунення запахів.
Для медицини дезінфікуючі властивості озону також незамінні. Їм знезаражують рани, фізіологічні розчини. Озонують венозну кров, а також «пахне» газом лікують ряд хронічних захворювань.
Знаходження в природі та значення
Просте речовина озон – елемент газового складу стратосфери, області навколоземного простору, розташованої на відстані близько 20-30 км від поверхні планети. Виділення цього з’єднання відбувається під час процесів, пов’язаних з електричними розрядами, при зварюванні, роботі апаратів ксерокса. Але саме у стратосфері утворюється і містить 99% від загальної кількості озону, що знаходиться в атмосфері Землі.
Життєво важливим виявилося присутність газу в навколоземному просторі. Він утворює у ньому так званий озоновий шар, який захищає все живе від смертельного ультрафіолетового випромінювання Сонця. Як не дивно, але нарівні з величезною користю, сам газ небезпечний для людей. Підвищення концентрації озону в повітрі, яким дихає людина, шкідливо для організму, внаслідок його крайньої хімічної активності.