Гідроген Н – хімічний елемент, один з найпоширеніших у нашому Всесвіті. Маса водню як елемента в складі речовин, що становить 75 % від загального вмісту атомів іншого типу. Він входить в найважливіша і життєво необхідне з’єднання на планеті – воду. Відмінною особливістю водню також є те, що він перший елемент періодичної системи хімічних елементів Менделєєва Д. І..
Відкриття і дослідження
Перші згадки про водні працях Парацельса датуються шістнадцятим століттям. Але його виділення з газової суміші повітря і дослідження властивостей горючих були зроблені вже в сімнадцятому столітті ученим Лемері. Досконально вивчив гідроген англійський хімік, фізик і природодослідник Генрі Кавендіш, який досвідченим шляхом довів, що маса водню найменша в порівнянні з іншими газами. На наступних етапах розвитку науки багато вчених працювали з ним, зокрема Лавуазье назвав його «народжує воду».
Характеристика за положенням у ПСХЭ
Елемент, що відкриває періодичну таблицю Менделєєва Д. І., – це водень. Фізичні і хімічні властивості атома проявляють певну подвійність, так як гідроген одночасно відносять до першої групи, головної підгрупи, якщо він веде себе як метал і віддає єдиний електрон в процесі хімічної реакції, і до сьомої – у разі повного заповнення валентної оболонки, тобто прийомі негативної частки, що характеризує його як подібний галогенам.
Особливості електронної будови елемента
Властивості атома водню, складних речовин, до складу яких він входить, і самого простого речовини Н2 в першу чергу визначаються електронною конфігурацією гідрогена. Частинка має один електрон з Z= (-1), який обертається по орбіті навколо ядра, що містить один протон з одиничною масою і позитивним зарядом (+1). Його електронна конфігурація записується як 1s1, що означає наявність однієї негативної частки на самій першою і єдиною для гідрогена s-орбіталі.
При відриві або віддачі електрона, а атом цього елемента має таку властивість, що ріднить його з металами, виходить катіон. По суті іон водню – це позитивна елементарна частинка. Тому позбавлений електрона гідроген називають просто протоном.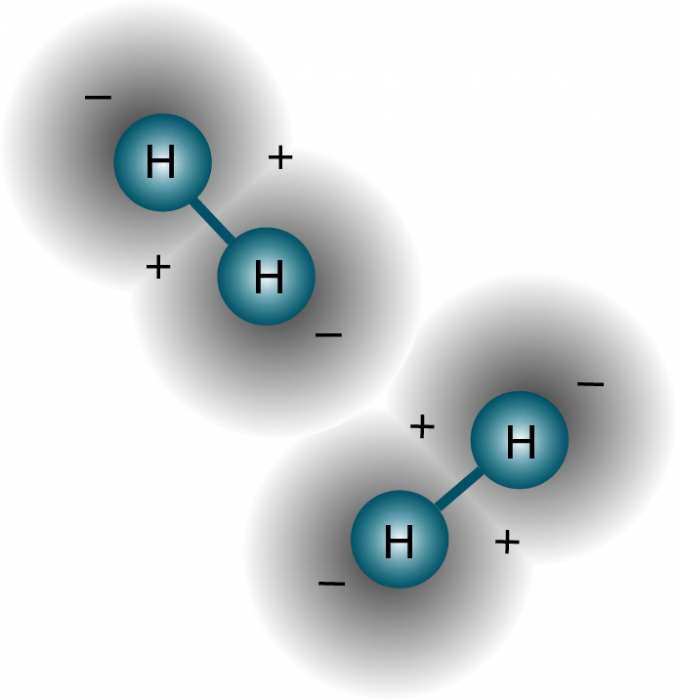
Фізичні властивості
Якщо описувати фізичні властивості водню коротко, то це безбарвний, малорозчинний газ з відносною атомною масою, що дорівнює 2, в 14,5 рази легше, ніж повітря, з температурою скраплення, складовою -252,8 градуси Цельсія.
На досвіді можна легко переконатися в тому, що Н2 найлегший. Для цього достатньо наповнити три кулі різними речовинами – воднем, вуглекислим газом, звичайним повітрям – і одночасно випустити їх з руки. Швидше за всіх досягне землі той, який наповнений З2, після нього опуститься надутий повітряною сумішшю, а містить Н2 зовсім підніметься до стелі.
Маленька маса і розмір часток водню обґрунтовують його здатність проникати через різні речовини. На прикладі того ж кулі в цьому легко переконатися, через пару днів він сам підніметься, так як газ просто пройде через гуму. Також водень може накопичуватися у структурі деяких металів (паладій або платина), а при підвищенні температури випаровуватися з неї.
Властивість малорастворимости водню використовують в лабораторній практиці для його виділення способом витіснення води. Фізичні властивості водню (таблиця, зображена нижче, містить основні параметри) визначають сфери його застосування і методи отримання.
| Параметр атома або молекули простої речовини | Значення |
| Атомна маса (молярна маса) | 1,008 г/моль |
| Електронна конфігурація | 1s1 |
| Кристалічна решітка | Гексагональна |
| Теплопровідність | (300 K) 0,1815 Вт/(м·К) |
| Щільність при н. у. | 0,08987 г/л |
| Температура кипіння | -252,76 °C |
| Питома теплота згоряння | 120,9·106 Дж/кг |
| Температура плавлення | -259,2 °C |
| Розчинність у воді | 18,8 мл/л |
Ізотопний склад
Як і багато інші представники періодичної системи хімічних елементів, гідроген має кілька природних ізотопів, тобто атомів з однаковим числом протонів в ядрі, але різним числом нейтронів – частинок з нульовим зарядом і одиничною масою. Приклади атомів, що володіють подібним властивістю – кисень, вуглець, хлор, бром та інші, в тому числі радіоактивні.
Фізичні властивості водню 1Н, найпоширенішого з представників даної групи, значно відрізняються від таких же характеристик його побратимів. Зокрема, різняться особливості речовин, до складу яких вони входять. Так, існує звичайна і дейтерированная вода, що містить в своєму складі замість атома водню з одним-єдиним протоном дейтерій 2Н – його ізотоп з двома елементарними частинками: позитивної і незарядженої. Цей ізотоп в два рази важче звичайного гідрогена, що і пояснює відмінність у властивостях сполук, що вони утворюють. У природі дейтерій зустрічається в 3200 разів рідше, ніж водень. Третій представник – тритій 3М, в ядрі він має два нейтрона і один протон.
Способи отримання і виділення
Лабораторні і промислові методи одержання водню дуже відрізняються. Так, в малих кількостях газ одержують у основному з допомогою реакцій, в яких беруть участь мінеральні речовини, а великомасштабні виробництва більшою мірою використовують органічний синтез.
В лабораторії застосовують такі хімічні взаємодії:
- Реакція лужних і лужноземельних металів з водою з утворенням лугу і шуканого газу.
- Електроліз водного розчину електроліту, на аноді виділяється Н2?, а на катоді – кисень.
- Розкладання гідридів лужних металів водою, продуктами є луг і, відповідно, газ Н2?.
- Взаємодія розбавлених кислот з металами з утворенням солей і Н2?.
- Дія лугів на кремній, алюміній і цинк сприяє виділенню водню паралельно з утворенням комплексних солей.

У промислових інтересах газ отримують такими методами, як:
- Термічний розклад метану в присутності каталізатора до складових його простих речовин (350 градусів досягає значення такого показника, як температура) – водню Н2? і вуглецю С.
- Пропускання пароподібної води через кокс при 1000 градусів Цельсія з утворенням вуглекислого газу СО2 і Н2? (найпоширеніший метод).
- Конверсія газоподібного метану на нікелевому каталізаторі при температурі, що досягає 800 градусів.
- Водень є побічним продуктом при електролізі водних розчинів хлоридів калію або натрію.
Хімічні взаємодії: загальні положення
Фізичні властивості водню в чому пояснюють його поведінку в процесах реагування з тим чи іншим з’єднанням. Валентність гідрогена дорівнює 1, так як він в таблиці Менделєєва розташований у першій групі, а ступінь окиснення виявляє різну. У всіх з’єднаннях, крім гідридів, водень в с. о.= (1+), в молекулах типу ХП, ХП2, ХП3 – (1-).
Молекула газу водню, утворена за допомогою створення узагальненої електронної пари, складається з двох атомів і досить стійка енергетично, саме тому при нормальних умовах кілька інертна і вступає в реакції при зміні нормальних умов. В залежності від ступеня окислення водню у складі інших речовин, він може виступати як в якості окислювача, так і відновника.
Речовини, з якими реагує і які утворює водень
Елементні взаємодії з утворенням складних речовин (часто при підвищених температурах):
- Лужний і лужноземельний метал + водень = гідрид.
- Галоген + Н2 = галогеноводород.
- Сірка + водень = сірководень.
- Кисень + Н2 = вода.
- Вуглець + водень = метан.
- Азот + Н2 = аміак.
Взаємодія зі складними речовинами:
- Одержання синтез-газу з монооксиду вуглецю і водню.
- Відновлення металів з їх оксидів з допомогою Н2.
- Насичення воднем ненасичених аліфатичних вуглеводнів.
Воднева зв’язок
Фізичні властивості водню такі, що дозволяють йому, перебуваючи в поєднанні з електронегативний елемент, утворювати особливий тип зв’язку з таким же атомом із сусідніх молекул, що мають неподеленные електронні пари (наприклад, киснем, азотом і фтором). Найяскравіший приклад, на якому краще розглянути явище, – це вода. Вона, можна сказати, прошита водневими зв’язками, які слабкіші ковалентних або іонних, але за рахунок того, що їх багато, значно впливають на властивості речовини. По суті, воднева зв’язок – це електростатичне взаємодія, яке зв’язує молекули води в димери і полімери, обґрунтовуючи її високу температуру кипіння.
Гідроген у складі мінеральних сполук
До складу всіх неорганічних кислот входить протон – катіон такого атома, як водень. Речовина, кислотний залишок якого має ступінь окислення більше (-1), називається многоосновным з’єднанням. У ньому є кілька атомів водню, що робить дисоціацію у водних розчинах багатоступеневою. Кожен наступний протон відривається від залишку кислоти все важче. За кількісним вмістом воднів в середовищі визначається його кислотність.

Водень і містять гідроксильні групи підстав. У них водень сполучений з атомом кисню, в результаті ступінь окислення цього залишку лугу завжди дорівнює (-1). За змістом гідроксілов в середовищі визначається її основність.
Застосування в діяльності людини
Балони із речовиною, так само як і ємності з іншими зрідженими газами, наприклад киснем, мають специфічний зовнішній вигляд. Вони пофарбовані в темнувато-зелений колір з яскраво-червоним написом «Водень». Газ накачують у балон під тиском близько 150 атмосфер. Фізичні властивості водню, зокрема легкість газоподібного агрегатного стану, використовують для наповнення їм в суміші з гелієм аеростатів, куль-зондів і т. д.
Водень, фізичні і хімічні властивості якого люди навчилися використовувати багато років тому, на сьогоднішній момент задіяний у багатьох галузях промисловості. Основна його маса йде на виробництво аміаку. Також водень бере участь в отриманні металів (гафнію, німеччина, галію, кремнію, молібдену, вольфраму, цирконію та інших) з оксидів, виступаючи у реакції в якості відновника, синильної і соляної кислот, метилового спирту, а також штучного рідкого палива. Харчова промисловість використовує його для перетворення олії у тверді жири.
Визначили хімічні властивості і застосування водню в різних процесах гідрогенізації та гідрування жирів, вугілля, вуглеводнів, масел і мазуту. З допомогою нього виробляють дорогоцінні камені, лампи розжарювання, проводять кування і зварювання металевих виробів під впливом киснево-водневого полум’я.







подобається…..