Галогеналкани – це з’єднання граничного вуглеводневого радикала з галогенами — йодом, бромом, хлором і фтором. Ці сполуки використовуються в різних галузях. У медицині, хімічному виробництві органічних сполук, синтезі пластиків і навіть в холодильній промисловості не обходиться без участі галогеналканів.
Що таке галогеналкани, формули, види
Галогеналкани — це з’єднання на основі алканового радикала і одного або декількох ( зазвичай не більше двох-трьох ) іонів галогена. Галогеналкани є вуглеводневу ланцюжок, пряму, циклічну або розгалужену, в різних місцях якої на місці однієї або декількох вуглеводневих присутній з’єднання з атомом галогена. Галогеналкани прийнято розділяти в першу чергу по виду галогена, за допомогою якого вони утворені:
- хлоралкани;
- фторалкани;
- бромалкани;
- йодалкани.
Саме це їх відмінність відіграє найбільшу роль в хімічних або фізичні властивості галогеналканів. Також зустрічаються алкани змішаного типу, наприклад, фторхлорметан.

Галогеналкани
Формула молекули галогеналкана з прямим ланцюжком має вигляд:
CnH2n + 2-kHalk, де k — кількість атомів галогена.
Формула будь-якого іншого з’єднання брутто матиме аналогічний вид алкана, на основі якого вона сформована, з тією лише різницею, що атомів водню в ній буде на k одиниць менше, а атомів галогена — на k одиниць більше. Як вже говорилося, k зазвичай приймає значення не більше трьох.
Ізомерія і номенклатура галогеналканів, формули
Варто перш за все визначитися з тим, яка будова має молекула галогеналкана, як вона при цьому буде називатися і чим буде відрізнятися структурна формула і брутто-формула.
Наприклад, ось структурна формула хлорциклогексану:
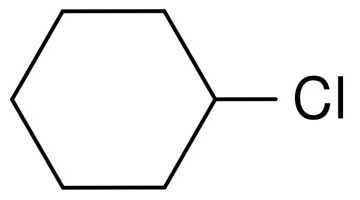
Структурна формула хлорциклогексану
Брутто-формула цього галогеналкана виглядає так: C6H11Cl.
Не треба плутати з бензойним кільцем, де один атом вуглецю з’єднаний з одним тільки атомом водню або його заступника! Тут граничне кільце, де використовуються всі чотири валентних зв’язку вуглецю, з яких дві пов’язані з іншими атомами вуглецю, а дві що залишилися — з атомами водню або заступника. В даному випадку хлору.
Ось інший галогеналкан – хлороформ, або метил-3-хлорид:
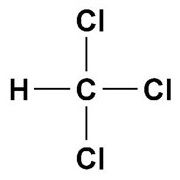
Формула хлороформ
Його брутто-формула CHCl3.
Ось 2-хлоплутаний:
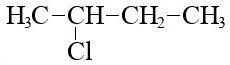
Формула 2-хлопця
Брутто-формула 2-хлоп’ятувана C4H9Cl.
А ось 3-етил-2,5-бромгексан:
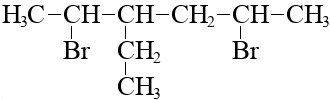
Формула 3-етил-2,5-бромгексана
Його брутто-формула C8H16Br2.
Для циклоалканів найменування вказує те, на яких місцях знаходяться атоми галогена в молекулі граничного циклорадикала, в основному це радикал на основі ціклогексану. Атоми галогена при виборі найменування з’єднання мають найнижчий пріоритет: нижче, ніж функціональна група, зв’язку з кратністю або ж вуглеводневий радикал:
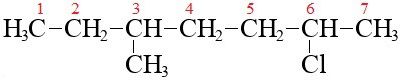
На цьому прикладі можна бачити молекулу 3-метил-6-хлоргептана. Тут нумерація йде ближче до того кінця, де самий визначальний властивості і структуру елемент, тут це метиловий радикал на третьому місці ланцюжка. І потім йдуть далі до кінця, зустрічають на шостому місці хлор і включають в найменування.
Крім традиції найменування « хлоргептан », « хлорметил », існує й інша. Вона застосовується у вітчизняній літературі. Наприклад, вже було використано найменування метил-3-хлорид, з’єднання, де три водневих зв’язку заміщені молекулами хлору. Воно повністю аналогічно найменуванню « трихлорметил », проте в даному випадку доречніше говорити « метил-3-хлорид », оскільки тут мова йде про саме трьох водневих зв’язках на одному вуглецевому ділянці. У разі більш складної молекули прийнято говорити « 2-дихлор » або « 4-трихлор », якщо на одній ділянці ланцюга знаходяться кілька атомів галогену. На листі « дихлор » і « тріхлор » пишуться не цифрами, а словами, щоб не вносити плутанину в структуру молекули.
Варто відразу ж сказати про структурні ізомерах — речовинах, що мають одну і ту ж брутто-формулу, але різний будова молекули. Як відомо, алкани, а також парафіни, часто представлені у вигляді різних структурних ізомерів. Наприклад, 2-метилгептан і 3-метилгептан мають абсолютно однакову брутто-формулу, але різний будова молекули. У першому випадку молекула метилового радикала знаходиться на другому місці, а в наступному — на третьому. При цьому обидва матимуть брутто-формулу C8H18.
Точно таку ж формулу матиме і будь-яке інше граничне вуглеводневе з’єднання нециклічна типу в залежності від числа атомів вуглецю — CnH2n + 2. Незалежно від будови, структури. Єдина ця формула охоплює величезну різноманітність молекул. Циклічна молекула матиме формулу кілька іншу, CnH2n.
У галогеналканах на місця деяких атомів воднів додаються атоми фтору, хлору, брому або йоду. Або ж з різними галогенними радикалами. Брутто-формула такого структурного з’єднання матиме вигляд CnH2n + 2-kHalk для нециклічних і CnH2n-kHalk для циклічних з’єднань. Тут і далі Hal — це один або кілька галогенів.
Крім структурних ізомерів, існують також стереомери, або оптичні ізомери. Їх структурна формула буде точно такий же, як і у своїх стереогомологів. Однак за фактом хімічні властивості можуть трохи відрізнятися. Вся справа в тому, що в просторі дані молекули можуть мати абсолютно різне розташування своїх атомів — завдяки структурі вуглецевого зв’язку. І можливо різне становище їх через різних варіантів, як молекула вуглецю може розташовуватися в зв’язку з цим. Зазвичай стереоизомери з’являються там, де існує розгалуження молекули з приєднанням вуглеводневого радикала і галогена, і таких стереоизомеров може бути дві штуки.
Фізичні властивості галогеналканів
Фізичні властивості галогеналканів досить цікаві. Саме завдяки їм вони мають своє практичне застосування. Завдяки тому, що радикали галогенів мають великий молярної масою, молекули галогеналканів частіше зустрічаються у вигляді рідин, ніж похідні молекули простих алканів.
Наприклад, один з галогеналканів – речовина хлороформ, розглянуте раніше, тріхлорметан, має в звичайних умовах властивості летючої рідини, в той час як метан, на основі якого вона була утворена, має газоподібну форму в тих же умовах. При цьому галогеналкани мають температуру кипіння, яка дозволяє використовувати їх в холодильному обладнанні, близьку до нуля градусів за Цельсієм. Наприклад, тріфторйодметан має температуру кипіння -24 ° C. Питома теплоємність і теплопровідність цих речовин також досить велика.
Звідси загальна назва деяких цих речовин — хладони, або фреони. Так-так, саме цією речовиною заповнені трубки холодильника у вас на кухні. У чистому вигляді ці речовини в системах охолодження застосовуються рідко, частіше використовують суміш з різних речовин. Зазвичай холодонами називають галогеналкани, підставою яких є метан або етан, рідше – пропан. Більші молекули, наприклад, 2-хлоргептан, вже будуть перебувати в звичайних умовах в рідкому вигляді. І це не дозволяє використовувати їх для охолодження. Для охолодження використовують ті галогеналкани, де на одному атомі вуглецю знаходяться два або три атома галогена — саме вони мають необхідні властивості, знижену температуру плавлення і кипіння.
Інші фізичні властивості галогеналканів:
- Низькомолекулярні не горять, не спалахують навіть при випаровуванні на відкритому повітрі. Високомолекулярні вже горять.
- Не мають кольору. Виняток — йодалкани, яким виділяється йод може надавати червонувату забарвлення.
- Галогеналкани на основі низькомолекулярних з’єднань метану і етану мають солодкуватий запах, інші — не мають запаху;
- Мають більш високу щільність, ніж їх алкановие аналоги без присутності атомів галогенів.
Хімічні властивості галогеналканів, реакції з галогеналкани, їх сполуки і взаємодії
Хімічні властивості галогеналканів обумовлені будовою їх молекул. Перш за все, галоненовий радикал володіє сильною електронегативністю, і відтягує електронне хмара в свою сторону. При цьому молекули на основі фтору виходять більш компактними, а молекули на основі йоду — більше « пухкими ». Саме це властивість фтору дозволяє молекулі стає більш щільною і проявляти потрібні для використання в охолодженні властивості.
В основному, реакції з галогеналканами проходять за такими схемами:
- Заміщення галогенового радикала — реакції нуклеофільного заміщення;
- Реакції нуклеофільного розщеплення, елімінування;
- Освіта металлорганічних сполук з цинком і магнієм;
- Деякі підтримую реакцію окислення — в основному високомолекулярні з’єднання.
Заміщення атома галогена в галогеналкані відбувається при синтезуванні різних спиртів:
CH3Cl + NaOH = CH3OH + NaCl;
У реакціях з галогеналканами з утворенням сполук амонію:
CH3Cl + NH4 = CH3NH3 + HCl;
А також в реакції Фіделя-Крафтса:
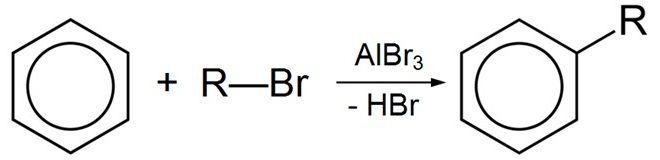
Реакції Фіделя-Крафтса
Нуклеофільное розщеплення відбувається з утворенням неграничного вуглеводневого з’єднання і виділенням галогеновиробної кислоти або її солі, з утворенням алкіна, а також з неповним заміщенням атома галогена:
монорозщеплення:
CH3CH2Br = CH2CH2 + HBr;
Розщеплення за участю другого реагенту:
CH3CH2CHBrCH3 + KOH = CH3CHCHCH3 + KBr + H2O;
Реакція з галогеналканами освіти металлорганіческого з’єднання з цинком:
CH3CH2I + 2Zn + CH3CH2I = CH3CH2ZnCH2CH3 + ZnI2.
Кілька особняком тут стоїть реакція Вюртца, при якій змінюється структура молекули вихідного алканового з’єднання:
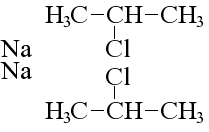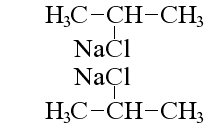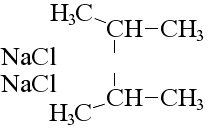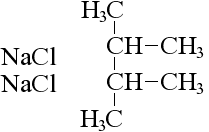
реакція Вюртца
Виробництво і отримання галогеналканів, рівняння
Розглянемо отримання галогеналканів різних видів.
Виробництво фторалканів відбувається на основі алкенов за допомогою реакції приєднання до них фторидів або фторводорода:
CH2CH2 + HF = CH3CH2F
Виробництво хлоралканов засноване на взаємодії алкінів з соляною кислотою і хлором, спиртів з хлором і хлорування сірковуглецю:
2CH4 + Cl2 = 2CH3Cl + H2;
CH3OH + HCl = CH3Cl + H2O;
CS2 + 2Cl2 = CCl4 + 2S
Виробництво бромалканів засноване на заміщення атома водню в алкені або алкані на атом брому при реакції з бромводородом:
RCHCH2 + HBr = RCH2CH2Br
Йодалкани виробляють при взаємодії спиртів з йодом і червоним фосфором по типу реакції, описаної раніше для хлоралканов.
Застосування галогеналканів
Основне застосування хлоралканов – це використання їх в якості холодоагентів. Частина галогеналканів використовується при виробництві вінілових пластиків — наприклад, поліхлорвінілу. Цей пластик йде на виготовлення гумового взуття, надувних човнів, шпалер і лінолеуму. Деяка частина галогеналканів використовується в хімічній промисловості при виробництві бензойних з’єднань.
Висновок
Галогеналкани – це прості за своєю структурою з’єднання, проте вони мають масу цікавих властивостей. Майже кожен з нас користуються ними щодня, відкриваючи дверцята холодильника або надягаючи куртку з вінілового волокна, легку і відразливу воду. Крім описаних вище реакцій з ними, існує і ряд інших цікавих реакцій з ними, наприклад, реакція Вюртца має більш складну природу, якщо заглиблюватися в її вивчення. Під час досліджень галогеналканів були відкриті багато хімічних законів, наприклад, правило Марковникова.






