Ферменти – це глобулярні білки, які допомагають протікати всім клітинним процесам. Як і всі каталізатори, вони не можуть повернути реакцію назад, а служать для її прискорення.
Локалізація ферментів у клітині
Всередині клітини індивідуальні ферменти, як правило, містяться і діють у чітко визначених органелах. Локалізація ферментів безпосередньо пов’язана з тією функцією, яку виконує дана ділянка клітини.
Майже всі ферменти гліколізу розташовуються в цитоплазмі. Ферменти циклу трикарбонових кислот – в матриксі мітохондрій. Активні речовини гідролізу містяться в лізосомах.
Окремі тканини і органи тварин і рослин відрізняються не тільки по набору ферментів, але і за їх активності. Таку особливість тканин використовують в клініці при діагностиці деяких захворювань.
Існують також вікові особливості активності і наборі ферментів в тканинах. Вони найбільш чітко помітні в період ембріонального розвитку при диференціюванні тканин.
Номенклатура ферментів
Існує кілька систем назв, кожна з яких враховує властивості ферментів різною мірою.
- Тривіальна. Назви речовин, що даються за випадковими ознаками. Наприклад, пепсин (pepsis – “травлення”, грец.) і трипсин (tripsis – “разжижаю”, грец.)
- Раціональна. Назва ферменту складається з субстрату і закінчення-аза». Наприклад, амілаза прискорює гідроліз крохмалю (amylo – “крохмаль”, грец.).
- Московська. Вона була прийнята в 1961 році міжнародною комісією за номенклатурою ферментів на V Міжнародному біохімічному конгресі. Назва речовини складається з субстрату і реакції, яка каталізується (прискорюється) ферментом. Якщо функція ферментів полягає в перенесенні групи атомів від однієї молекули (субстрату) до іншої (акцептору), назва каталізатора включає в себе і хімічну назву акцептора. Наприклад, в реакції перенесення аміногрупи з аланіну на 2-оксиглутарову кислоту бере участь фермент аланін: 2-оксоглутаратаминотрансфераза. Назва відображає:
- субстрат – аланін;
- акцептор – 2-оксоглутаровая кислота;
- в реакції переноситься аміногрупа.
Міжнародною комісією був складений список всіх відомих ферментів, який постійно доповнюється. Це пов’язано з відкриттям нових речовин.
Класифікація ферментів
 Ділити на ферменти групи можна двома способами. Перший пропонує два класи цих речовин:
Ділити на ферменти групи можна двома способами. Перший пропонує два класи цих речовин:
- прості – складаються тільки з білка;
- складні – містять білкову частину (апофермент) і небілкову, звану коферментом.
У небілковій частині складного ферменту можуть входити вітаміни. Взаємодія з іншими речовинами відбувається за допомогою активного центру. Цілком молекула ферменту не бере участі в процесі.
Властивості ферментів, як і інших білків, визначаються їх будовою. В залежності від нього каталізатори прискорюють тільки свої реакції.
Другий спосіб класифікації ділить речовини з того, яку функцію виконують ферменти. У результаті виходить шість класів:
- оксидоредуктази;
- трансферази;
- гідролази;
- ізомерази;
- ліази;
- лігази.
Це загальноприйняті групи, відрізняються вони не тільки за видами реакцій, які регулюють складаючі в них ферменти. У речовин різних груп відрізняється будова. І функції ферментів у клітині, отже, не можуть бути однаковими.
Оксидоредуктази – окисно-відновні
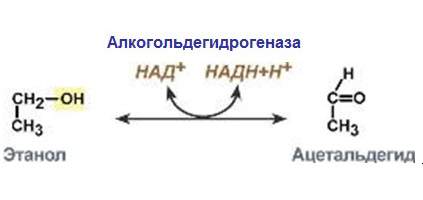
Основна функція ферментів першої групи – прискорення окисно-відновних реакцій. Характерна особливість: здатність утворювати ланцюги окислювальних ферментів, у яких здійснюється перенесення електронів або атомів водню від самого першого субстрату до кінцевого акцептору. Ці речовини поділяють за принципом роботи або за місцем роботи в реакції.
- Аеробні дегідрогенази (оксидази) прискорюють перенесення електронів або протонів безпосередньо на кисневі атоми. Анаеробні ж роблять ті ж дії, але в реакціях, що протікають без передачі електронів або атомів водню на кисневі атоми.
- Первинні дегідрогенази каталізують процес відняття атомів водню від субстрату речовини (первинного субстрату). Вторинні – прискорюють зняття атомів водню з вторинного субстрату, отримані вони були за допомогою первинної дегідрогенази.
Інша особливість: будучи двохкомпонентними каталізаторами з дуже обмеженим набором коферментів (активних груп), вони можуть прискорювати безліч різноманітних реакцій окислення-відновлення. Це досягається великим числом варіантів: один і той же кофермент може приєднатися до різних апоферментам. У кожному разі виходить особлива оксидоредуктаза зі своїми властивостями.
Існує ще одна функція ферментів цієї групи, про яку не можна не згадати – вони прискорюють протікання хімічних процесів, пов’язаних з виділенням енергії. Такі реакції називаються екзотермічними.
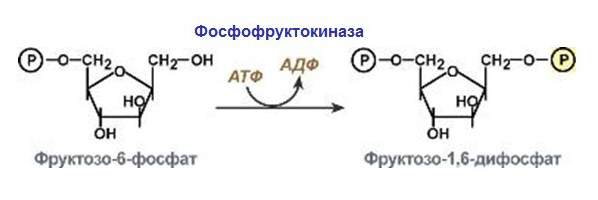
Трансферази – переносники
Ці ферменти виконують функцію прискорення реакцій переносу молекулярних залишків і функціональних груп. Наприклад, фосфофруктокиназа.
Виділяють вісім груп каталізаторів, виходячи з переносимої групи. Розглянемо тільки деякі з них.
- Фосфотрансферази – допомагають переносити залишки фосфорної кислоти. Вони діляться на підкласи відповідно до пункту призначення (спиртові, карбоксильні та інші).
- Амінотрансферази – прискорюють реакції переамінування амінокислот.
- Глікозилтрансферази – переносять глікозильні залишки з молекул фосфорних ефірів до молекул моно – і полісахаридів. Забезпечують реакції розпаду і синтезу оліго – або полісахаридів в організмах рослин і тварин. Наприклад, вони беруть участь у реакції розпаду сахарози.
- Ацилтрансферази переносять залишки карбонових кислот на аміни, спирти та амінокислоти. Ацил-коензим-А є універсальним джерелом ацильних груп. Його можна розглядати як активну групу ацилтрансфераз. Найчастіше переноситься ацил оцтової кислоти.
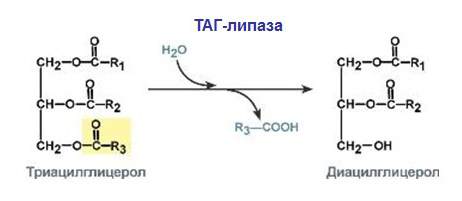
Гідролази – розщеплюють з участю води
У цій групі ферменти виконують функцію каталізаторів для реакцій розщеплення (рідше синтезу) органічних сполук, у яких бере участь вода. Речовини цієї групи містяться в клітках і в шлунковому соці. Молекули каталізаторів в ШКТ складаються з одного компонента.
Місцем локалізації цих ферментів є лізосоми. Вони виконують захисні функції ферментів у клітині: розщеплюють чужорідні речовини, що пройшли через мембрану. Вони також знищують ті речовини, які більше не потрібні клітці, за що лізосоми були прозвані санітарами.
 Інше їх “прізвисько” – клітинні самогубці, так як вони є головним інструментом для аутолізу клітини. Якщо з’явилася інфекція, почалися запальні процеси, мембрана лізосом стає проникною і гідролази виходять в цитоплазму, руйнуючи все на своєму шляху, знищуючи клітку.
Інше їх “прізвисько” – клітинні самогубці, так як вони є головним інструментом для аутолізу клітини. Якщо з’явилася інфекція, почалися запальні процеси, мембрана лізосом стає проникною і гідролази виходять в цитоплазму, руйнуючи все на своєму шляху, знищуючи клітку.
Розділяють декілька видів каталізаторів з цієї групи:
- естерази – відповідають за гідроліз складних ефірів, спиртів;
- глікозідази – прискорюють гідроліз глікозидів, залежно від того, на якій ізомер вони діють, виділяють ? – або -глікозідази;
- пептид-гідролази – відповідальні за гідроліз пептидних зв’язків у білках, а за певних умов і за їх синтез, але цей спосіб синтезу білка не використовується в живій клітині;
- амідази – відповідають за гідроліз амідів кислот, наприклад, уреаза каталізує розпад сечовину на аміак і воду.
Ізомерази – перетворення молекули
Ці речовини прискорюють зміни в межах однієї молекули. Вони можуть бути геометричні або структурні. Це може відбуватися різними способами:
- перенесення атомів водню;
- переміщення фосфатної групи;
- зміна розташування атомних угруповань у просторі;
- переміщення подвійного зв’язку.
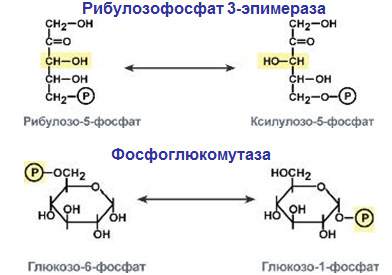
Ізомеризації можуть бути піддані органічні кислоти, вуглеводи або амінокислоти. Изомеразы можуть перетворювати альдегіди в кетони і, навпаки, цис-форму перебудувати в транс-форму і назад. Щоб краще зрозуміти, яку функцію виконують ферменти цієї групи, необхідно знати відмінності ізомерів.
Ліази рвуть зв’язки
Ці ферменти прискорюють негідролітичний розпад органічних сполук зв’язків:
- вуглець-вуглець;
- фосфор-кисень;
- вуглець-сірка;
- вуглець-азот;
- вуглець-кисень.
При цьому виділяються такі найпростіші продукти, як вуглекислий газ, вода, аміак, і замикаються подвійні зв’язки. Деякі з цих реакцій можуть піти у зворотний бік, відповідні ферменти в придатних для цього умовах каталізують процеси не тільки розпаду, але і синтезу.
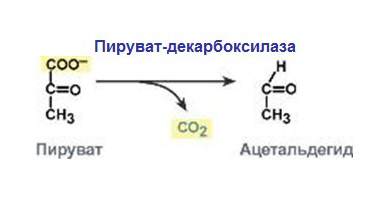 Класифікація ліаз відбувається за типом зв’язку, яку вони розривають. Вони є складними ферментами.
Класифікація ліаз відбувається за типом зв’язку, яку вони розривають. Вони є складними ферментами.
Лігази зшивають
Головна функція ферментів цієї групи – прискорення реакцій синтезу. Їх особливість – спряженість створення з розпадом речовин, які здатні дати енергію для здійснення біосинтетичного процесу. Існує шість підкласів за типом утворення зв’язку. П’ять з них ідентичні підгрупах ліаз, а шоста відповідає за створення зв’язку “азот-метал”.
 Деякі лігази беруть участь в особливо важливих процесах клітини. Наприклад, ДНК-лігаза бере участь у реплікації дезоксирибонуклеїнової кислоти. Вона зшиває одноланцюгові розриви, створюючи нові фосфодиефірні зв’язку. Саме вона з’єднує фрагменти Оказакі.
Деякі лігази беруть участь в особливо важливих процесах клітини. Наприклад, ДНК-лігаза бере участь у реплікації дезоксирибонуклеїнової кислоти. Вона зшиває одноланцюгові розриви, створюючи нові фосфодиефірні зв’язку. Саме вона з’єднує фрагменти Оказакі.
Цей фермент активно використовується в генній інженерії. Він дозволяє вченим зшивати молекули ДНК із необхідних їм шматочків, створюючи унікальні ланцюжка дезоксирибонуклеїнової кислоти. У них можна закласти будь-яку інформацію, створивши таким чином фабрику по виготовленню необхідних білків. Наприклад, можна вшити в ДНК бактерії шматочок, який відповідає за синтез інсуліну. І коли клітина буде транслювати власні білки, вона заодно наробить і корисна речовина, необхідне в медичних цілях. Його залишається лише очистити, і воно допоможе безлічі хворих людей.
Величезна роль ферментів в організмі
Вони можуть збільшити швидкість реакції більш ніж у десять разів. Це просто необхідно для нормальної життєдіяльності клітини. А ферменти беруть участь у кожній реакції. Тому функції ферментів в організмі різноманітні, як і всі протікають процеси. А порушення роботи цих каталізаторів призводить до тяжких наслідків.
Широко застосовуються ферменти в харчовій, легкій промисловості, медицині: використовуються для виготовлення сирів, ковбас, консервів, входять до складу пральних порошків. Також їх використовують у виготовленні фотоматеріалів.






