Самими простими органічними сполуками є граничні і неграничні вуглеводні. До них відносять речовини класу алканів, алкіной, алкенів.
Формули їх включають атоми водню і вуглецю в певній послідовності і кількості. Вони часто зустрічаються в природі.
Визначення алкенів
Інше їх назва – олефіни або етиленові вуглеводні. Саме так назвали цей клас сполук у 18 столітті при відкритті маслянистої рідини ? хлористого етилену.
До алкенам відносяться речовини, що складаються з водневих і вуглецевих елементів. Вони відносяться до ациклическим вуглеводнів. В їх молекулі присутня єдина подвійна (ненасыщенная) зв’язок, що з’єднує два вуглецевих атома між собою.
Формули алкенів
Кожен клас сполук має своє хімічне позначення. У них символами елементів періодичної системи вказується склад і структура зв’язку кожної речовини.
Загальна формула алкенів позначається наступним чином: CnH2n, де n більше або дорівнює 2. При її розшифровці видно, що на кожний атом вуглецю припадає по два атома водню.
Молекулярні формули алкенів з гомологічного ряду представлені наступними структурами: C2H4, C3H6, C4H8, C5H10, C6H12, C7H14, C8H16, C9H18, C10H20. Видно, що кожний наступний вуглеводень містить на один більше вуглецю і на 2 більше водню.
Існує графічне позначення розташування і порядку хімічних сполук між атомами в молекулі, яке показує формула алкенів структурна. З допомогою валентних рисок позначається зв’язок вуглеців з водородами.
Формула алкенів структурна може бути зображена у розгорнутому вигляді, коли показуються всі хімічні елементи і зв’язку. При більш короткому вираженні олефінів не показується з’єднання вуглецю і водню за допомогою валентних рисок.
Формулою скелетної позначають найпростішу структуру. Ламаною лінією зображують основу молекули, в якій атоми вуглецю представлені її верхівками і кінцями, а ланками вказують водень.
Як утворюються найменування олефінів
Виходячи з систематичної номенклатури, формули алкенів і їх назви становлять структури з алканів, що належать до граничних вуглеводнів. Для цього в найменуванні останніх суфікс -ан замінюють на -илен або -ен. Прикладом може служити утворення бутилену з бутану, а пентена з пентану.
Для позначення положення зв’язку подвійний щодо атомів вуглецю вказують арабську цифру в кінці найменування.
В основі назви алкенів лежить позначення вуглеводню з самою довгою ланцюжком, в якій присутня подвійна зв’язок. За початок нумерації ланцюга зазвичай вибирають кінець, який найближче розташований до непредельному з’єднання атомів вуглецю.
Якщо структурна формула алкенів має відгалуження, то вказують назви радикалів і їх кількість, а перед ними ставлять цифри, відповідні місця в вуглецевої ланцюжку. Потім слід найменування самого вуглеводню. Після цифр зазвичай ставлять дефіс.
Існують неграничні радикальні відгалуження. Їх назви можуть бути тривіальними або утворюються за правилами систематичної номенклатури.
Наприклад, ННМ=СН – іменується этенилом або вінілом.
Ізомери
Молекулярні формули алкенів не можуть вказувати на ізомерію. Проте для даного класу речовин, за винятком этиленовой молекули, притаманне просторове видозміна.
Ізомери етиленових вуглеводнів можуть бути з вуглецевого скелету, по положенню непредельной зв’язку, міжкласові або просторові.
Загальна формула алкенів визначає кількість атомів вуглецю і водню в ланцюжку, проте по ній не видно наявність і розташування подвійного зв’язку. Прикладом може служити циклопропан як міжкласовий ізомер C3H6 (пропілену). Інші види ізомерії проявляються у C4H8 або бутена.
Різне становище непредельной зв’язку спостерігається у бутена-1 або бутена-2, у першому випадку подвійне з’єднання знаходиться біля першого атома вуглецю, а в другому – в середині ланцюга. Ізомерію з вуглецевого скелету можна розглянути на прикладі метилпропена (CH3-C(CH3)=CH2) і ізобутилена ((СН3)2С=СН2).
Просторове видозміна притаманне бутену-2 в транс – і цис – положенні. У першому випадку бічні радикали розміщуються зверху і знизу від основної вуглецевого ланцюга з подвійним зв’язком, у другому ізомері заступники знаходяться на одній стороні.
Характеристика олефінів
Загальна формула алкенів визначає фізичний стан всіх представників даного класу. Починаючи з етилену і закінчуючи бутиленом (від2 до4), речовини перебувають у газоподібному вигляді. Так у безбарвного этена є солодкуватий запах, мала розчинність у воді, молекулярна маса менше, ніж у повітря.
В рідкій формі представлені вуглеводні гомологічного проміжку від5 до17. Починаючи з алкена, що має в основний ланцюга 18 атомів вуглецю, відбувається перехід фізичного стану у тверду форму.
Всім олефинам зараховують погану розчинність у водному середовищі, зате хорошу у розчинниках органічної природи, як бензол або бензину. Їх молекулярна маса менше, ніж у води. Збільшення вуглецевого ланцюжка призводить до підвищення температурних показників при плавленні та кипінні даних сполук.
Властивості олефінів
Структурна формула алкенів показує наявність в скелеті подвійний зв’язку з ? – і ? – з’єднання двох атомів вуглецю. Така будова молекули зумовлює її хімічні властивості. Зв’язок-? вважається не дуже міцною, що дає можливість її руйнувати з формуванням нових двох зв’язків-?, які отримуються в результаті приєднання пари атомів. Ненасичені вуглеводні є електронними донорами. Вони беруть участь у процесах приєднання за электрофильному типу.
Важливим хімічною властивістю всіх алкенів є процес галогенирования з виділенням сполук, подібних дигалогенопроизводным речовин. Галогенові атоми здатні прикріплюватися за подвійним з’єднанню до вуглеводам. Прикладом може служити бромирование пропілену з формуванням 1,2-дибромпропана:
H2C=CH–CH3 + Br2 ? BrCH2–CHBr–CH3.
Даний процес нейтралізації кольору в бромної води алкенами вважається якісним доказом наявності подвійного зв’язку.
До важливих реакцій відноситься гідрування олифинов з приєднанням молекули водню під дією каталітичних металів типу платини, паладію або нікелю. В результаті утворюються вуглеводні з насиченою зв’язком. Формули алканів, алкенів наведені нижче в реакції гідрування бутена:
CH3–CH2–CH=CH2 + H2 Ni? CH3–CH2–CH2–CH3.
Процес приєднання молекули галогеноводорода до олефинам називається
гидрогалогенированием, що проходить за правилом, відкритого Марковниковым. Прикладом може служити гидробромирование пропілену з утворенням 2-бромпропана. У ньому водень з’єднується при подвійний зв’язку з вуглецем, який вважається найбільш гидрогенизированным:
CH3–CH=CH2 + HBr ? CH3–BrCH–CH3.
Реакція приєднання алкенами води під дією кислот носить назву гідратації. У результаті виходить молекула спирту пропанола-2:
CH3–HC=CH2 + H2O ? CH3–OHCH–CH3.
При впливі на алкени сірчаної кислотою відбувається процес сульфування:
CH3–HC=CH2 + HO?OSO?OH ? CH3–CH3CH–O?SO2?OH.
Реакція протікає з утворенням кислих ефірів, наприклад, ізопропілсерной кислоти.
Алкени схильні до окислення під час їх спалювання при дії кисню з утворенням води і вуглекислого газу:
2CH3–HC=CH2 + 9O2 ? 6CO2 + 6H2O.
Взаємодія олефінових з’єднань і розбавленого калію перманганату у формі розчину призводить до виникнення гліколів або двоатомних спиртів будови. Ця реакція також є окисної з утворенням етиленгліколю та знебарвлення розчину:
3H2C=CH2 + 4H2O+ 2KMnO4 ? 3OHCH–CHOH+ 2MnO2 +2KOH.
Молекули алкенів можуть бути задіяні в процесі полімеризації з свободнорадикальным або катіонно-аніонним механізмом. У першому випадку під впливом пероксидів виходить полімер типу поліетилену.
За другим механізмом катионными виступають каталізаторами кислоти, а аніонними є речовини металлорганические з виділенням стереоселективного полімеру.
Що таке алкани
Їх ще називають парафинами або граничними ациклічні вуглеводні. Вони мають лінійної або розгалуженої структурою, яка містить тільки насичені прості зв’язки. Всі представники гомологічного ряду даного класу мають загальну формулу CnH2n+2.
В їх складі присутні тільки атоми вуглецю і водню. Загальна формула алкенів утворюється з позначення граничних вуглеводнів.
Назви алканів та їх характеристика
Найпростішим представником цього класу є метан. За ним слідують речовини типу етану, пропану і бутану. В основі назви лежить корінь числівника на грецькій мові, до якого додають суфікс -ан. Найменування алканів занесені в номенклатуру IUPAC.
Загальна формула алкенів, алкіной, алканів включає тільки два різновиди атомів. До них належать елементи вуглецю і водню. Кількість вуглецевих атомів у всіх трьох класах співпадає, відмінність спостерігається лише в чисельності водню, який може отщепляться або приєднуватися. З насичених вуглеводнів одержують ненасичені сполуки. У представників парафінів в молекулі міститься на 2 атома водню більше, ніж у олефінів, що підтверджує загальна формула алканів, алкенів. Алкенів структура вважається ненасиченої за рахунок наявності подвійного зв’язку.
Якщо співвіднести число водневих і вуглецевих атомів в алканах, то значення буде максимальною порівняно з іншими класами вуглеводнів.
Починаючи з метану і закінчуючи бутаном (від1 до4), речовини перебувають у газоподібному вигляді.
В рідкій формі представлені вуглеводні гомологічного проміжку від5 до16. Починаючи з алкана, що має в основний ланцюга 17 атомів вуглецю, відбувається перехід фізичного стану у тверду форму.
Для них характерна ізомерія за вуглецевого скелету та оптичні видозміни молекули.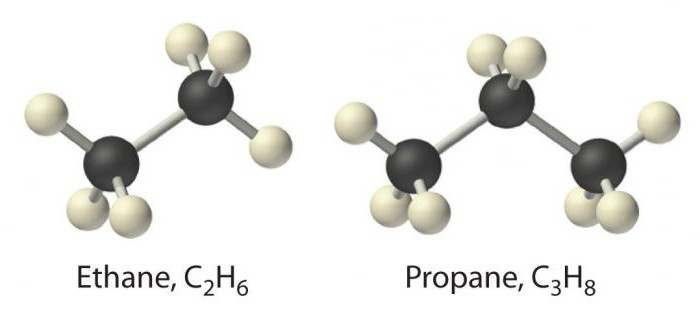
У парафінах вуглецеві валентності вважаються повністю зайнятими сусідніми вуглеводами або водородами з утворенням зв’язку ?-типу. З хімічної точки зору це обумовлює їх слабкі властивості, саме тому алкани носять назву граничних чи насичених вуглеводнів, позбавлених спорідненості.
Вони вступають в реакції заміщення, пов’язані з галогенированием щодо радикального типу, сульфохлорированием або нитрованием молекули.
Парафіни піддаються процесу окиснення, горіння або розкладання при високих температурах. Під дією прискорювачів реакцій відбувається відщеплення атомів водню або дегідрування алканів.
Що таке алкины
Їх ще називають ацетиленовыми вуглеводнями, у яких в ланцюжку вуглецевої присутній потрійний зв’язок. Структура алкіной описується загальною формулою CnH2n–2. З неї видно, що на відміну від алканів, у ацетиленових вуглеводнів бракує чотири атома водню. Їх замінює потрійний зв’язок, утворена двома ? – з’єднаннями.
Така будова обумовлює хімічні властивості даного класу. Структурна формула алкенів і алкіной наочно показує ненасиченість їх молекул, а також наявність подвійної (H2CCH2) та потрійної (HC?CH) зв’язку.
Найменування алкіной і їх характеристика
Найпростішим представником є ацетилен або HC?CH. Його також називають этином. Відбувається воно від назви насиченого вуглеводню, в якому прибирають суфікс -ан і додають -ін. У найменуваннях довгих алкіной цифрою вказують розташування потрійний зв’язки.
Знаючи будову насичених і ненасичених вуглеводнів, можна визначити, під якою буквою позначена загальна формула алкіной: а) c n h 2n; в) c n h 2n+2; c) c n h 2n-2; г) c n h 2n-6. Правильною відповіддю буде третій варіант.
Починаючи з ацетилену і закінчуючи бутаном (від2 до4), речовини мають газоподібну природу.
В рідкій формі знаходяться вуглеводні гомологічного проміжку від5 до17. Починаючи з алкина, що має в основний ланцюга 18 атомів вуглецю, відбувається перехід фізичного стану у тверду форму.
Для них характерна ізомерія за вуглецевого скелету, по положенню зв’язку потрійний, а також міжкласові видозміни молекули.
За хімічним характеристикам ацетиленові вуглеводні подібні до алкенам.
Якщо у алкіной потрійний зв’язок кінцева, то вони виконують функцію кислоти з утворенням солей алкинидов, наприклад, NaC?CNa. Наявність двох ?-зв’язків робить молекулу ацетиледина натрію сильним нуклеофилом, вступає в реакції заміщення.
Ацетилен піддається хлоруванню в присутності хлориду міді з отриманням діхлорацетілена, конденсації під дією галогеналкинов з виділенням диацетиленовых молекул.
Алкины беруть участь в реакціях електрофільного приєднання, принцип яких лежить в основі галогенирования, гидрогалогенирования, гидротації і карбонилирования. Однак такі процеси протікають слабкіше, ніж у алкенів з подвійним зв’язком.
Для ацетиленових вуглеводнів можливі реакції нуклеофільного приєднання по типу молекули спирту, первинного аміну або сірководню.